3.3.1การเกิดพันธะโคเวลเนต์

พันธะโคเวเลนต์(Covalent bond) มาจากคำว่า co
+ valence electron ซึ่งหมายถึง พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน ดังเช่น
ในกรณีของไฮโดรเจน ดังนั้นลักษณะที่สำคัญของ
พันธะโคเวเลนต์ก็คือการที่อะตอมใช้เวเลนต์อิเล็กตรอนร่วมกันเป็นคู่ ๆ
-สารประกอบที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์
เรียกว่าสารโคเวเลนต์
-โมเลกุลของสารที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์เรียกว่าโมเลกุลโคเวเลนต์
1. การเกิดพันธะโคเวเลนต์
เนื่องจาก พันธะโคเวเลนต์
เกิดจากการใช้เวเลนต์อิเล็กตรอนร่วมกัน ซึ่งอาจจะใช้ร่วมกันเพียง 1 คู่
หรือมากกว่า 1 คู่ก็ได้
- อิเล็กตรอนคู่ที่อะตอมทั้งสองใช้ร่วมกันเรียกว่า “อิเล็กตรอนคู่ร่วมพันธะ”
- อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่าอะตอมคู่ร่วมพันธะ
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1
คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะเดี่ยวเช่น ในโมเลกุลของไฮโดรเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2
คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะคู่เช่น ในโมเลกุลของออกซิเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3
คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะสามเช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนต์จะพบว่า
ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ
ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก
เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน
มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์
อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนต์คือ
BeCl2เป็นต้น

3.3.2 การเขียนสูตรและการเรียกชื่อสารประกอบโคเวเลนต์
การเขียนสูตรสารประกอบโคเวเลนต์เรียงตามหลักสากล
ดังนี้
Si C Sb As P N H Te S At I Br Cl O F
2. จากความรู้เรื่องกฎออกเตต
ทำให้สามารถทำนายสูตรอย่างง่ายของสารได้
โดยใช้ความต้องการอิเล็กตรอนคู่ร่วมพันธะของแต่ละอะตอมของธาตุคูณไขว้ เช่น
ตัวอย่างที่1สูตรของสารประกอบของธาตุ
H กับ S ; H และ S มีเวเลนต์อิเล็กตรอน 1 และ 6 ตามลำดับ ดังนั้น H และ S ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน
1 และ 2 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
ตัวอย่างที่ 2
สูตรของสารประกอบของธาตุ S กับ C ; S และ C มีเวเลนต์อิเล็กตรอน
6 และ 4 ตามลำดับ ดังนั้น S และ C ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 2 และ 4 ตามลำดับ
เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
ตัวอย่างที่ 3
สูตรของสารประกอบของธาตุ N กับ Cl ; N และ Cl
มีเวเลนต์อิเล็กตรอน
5 และ 7 ตามลำดับ ดังนั้น N และ Cl ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 3 และ 1 ตามลำดับ
เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย
การเรียกชื่อสารประกอบโคเวเลนต์(Names of
Covalent Compounds)
1.อ่านชื่อธาตุที่อยู่ด้านหน้าก่อนตามด้วยธาตุที่อยู่ด้านหลังโดยเปลี่ยนเสียงพยางค์ท้ายเป็นไ-ด์(ide
)2
2.อ่านระบุจำนวนอะตอมของธาตุด้วยเลขจำนวนในภาษากรีก
ได้แก่
1
=mono-2=di-3=tri-4=tetra-5=penta-6=hexa-7=octa-8=nona-9=deca-
3 .ถ้าธาตุแรกมีอะตอมเดียว
ไม่ต้องอ่านระบุจำนวนอะตอมของธาตุนั้นแต่ถ้าธาตุหลังมีเพียงหนึ่งอะตอมก็ต้องระบุจำนวนอะตอมด้วยเสมอ
ตัวอย่างการอ่านชื่อ
CO2อ่านว่าคาร์บอนไดออกไซด์,COอ่านว่าคาร์บอนมอนออกไซด์,
BF3อ่านว่าโบรอนไตรฟลูออไรด์,N2Oอ่านว่าไดไนโตรเจนมอนอกไซด์,
N2O5อ่านว่าไดไนโตรเจนเพนตอกไซด์, P4O10อ่านว่าเตตระฟอสฟอรัสเดคะออกไซด์
OF2อ่านว่าออกซิเจนไดฟลูออไรด์, CCl4อ่านว่าคาร์บอนเตตระคลอไรด์
3.3.3พลังงานพันธะ
พลังงานพันธะ (Bond energy) คือพลังงานที่ใช้ในการสลายพันธะระหว่างอะตอมของธาตุภายในโมเลกุลที่อยู่ในสถานะก๊าซออกเป็นอะตอมเดี่ยว
เช่น
H2(g) + 436 kJ ----------------> 2H (g)
จากสมการก๊าซ H21
โมลต้องการจะสลายเป็น H อะตอม 2 โมล ต้องใช้พลังงาน 436 kJ
HI (g) + 298 kJ----------> H (g) + I (g)
ก๊าซ HI 1 โมลต้องการสลายเป็น H และ I อะตอมอย่างละ 1โมลต้องใช้พลังงาน
298 kJ
จากตัวอย่างข้างต้นนี้แสดงว่าสารต่างชนิดกัน
จำนวนโมลเท่ากัน พลังงานที่ใช้สลายพันธะก็ต่างกัน
การสลายพันธะชนิดเดียวกันในสารต่างชนิดกันจะใช้พลังงานสลายไม่เท่ากัน เช่น
การสลายพันธะ C - H ใน CH4และ C2H6มีค่าไม่เท่ากัน
CH4(g) + 435 kJ -------------> CH3(g) + H (g)
C2H6(g) + 400 kJ ------------> C2H5(g) + H
(g)
และการสลายพันธะชนิดเดียวกันในสารเดียวกัน
(ที่มีพันธะชนิดเดียวกัน) ก็ใช้พลังงานสลายไม่เท่ากัน เช่น การสลายพันธะ C
- H ใน
CH4
CH4(g) + 435 kJ------------> CH3(g) + H (g)
CH3(g) + 464 kJ ------------> CH2(g) + H (g)
CH2(g) + 422 kJ -------------> CH (g) + H (g)
CH(g) + 339 kJ --------------> C (g) + H (g)
เมื่อรวมขั้นทั้ง 4
เข้าด้วยกันจะได้ว่า
CH4(g) + 1660 kJ --------------> C (g) + 4H
(g)
พลังงานที่ทำให้โมเลกุล CH4แตกออกเป็นอะตอมในสภาวะก๊าซ
เรียกว่า Atomization energy และพลังงานเฉลี่ยของพันธะ C - H ใน CH4=
1660/4 = 415 kJ เรียกพลังงานค่านี้ว่าพลังงานพันธะเฉลี่ย( Average bond energy
)อนึ่งจากตารางที่
6.1 ค่าพลังงานเฉลี่ยของพันธะ C - H ของสารทั่ว ๆ
ไป มีค่า 413 kJ ซึ่งมีค่าต่างจากค่าพลังงานเฉลี่ยของพันธะ C - H ซึ่งหาได้จาก CH4เท่านั้น
เนื่องจากพลังงานที่ใช้สลายพันธะแต่ละพันธะในคู่อะตอมเดียวกันไม่เท่ากัน
จึงเป็นการยากที่จะจดจำและไม่สะดวกต่อการใช้ ดังนั้นเพื่อความสะดวกจึงนิยมใช้พลังงานพันธะเฉลี่ยแทน
3.3.4หลักการทำนายรูปร่างโมเลกุลและไอออนโคเวเลนต์
หลักการทำนายรูปร่างโมเลกุลและไอออนโคเวเลนต์
1. ต้องทราบเวเลนต์อิเล็กตรอนแต่ละอะตอม
หรือทราบเลขอะตอมของธาตุ แล้วจัดเรียงอิเล็กตรอนในระดับพลังงานต่าง ๆ
ทำให้ทราบเวเลนต์อิเล็กตรอน
2. ต้องทราบสูตรเคมี ของสารที่จะทำนายรูปร่างโมเลกุล
3. นำข้อมูลข้อ 1. และข้อ 2.
มาเขียนสูตรโครงสร้างแบบจุด
หรือสูตรโครงสร้างแบบลิวอิส ตามโมเลกุลหรือไอออนของสารนั้น
4. พิจารณาดูที่อะตอมกลางของธาตุของสูตรโครงสร้างที่เขียนขึ้น
ว่ามีการจัดเรียงอิเล็กตรอนคู่ร่วมพันธะและอิเล็กตรอนคู่โดดเดี่ยว
ตลอดจนจำนวนพันธะว่าเป็นอย่างไร
เข้าข่ายลักษณะรูปร่างแบบไหนก็ทำนายเป็นรูปร่างโมเลกุลหรือไอออนแบบนั้น
ข้อสังเกตการทำนายรูปร่างของสารโคเวเลนต์ไม่ควร
เขียนสูตรโครงสร้างแบบเส้น เพราะอิเล็กตรอนคู่โดดเดี่ยวจะไม่ปรากฏ
ซึ่งจะทำให้ทำนายรูปร่างของสารโคเวเลนต์ผิดได้
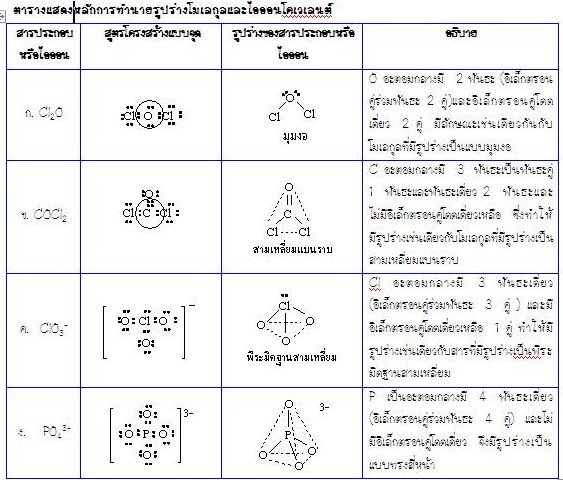
ตัวอย่างจงทำนายรูปร่างของสารโคเวเลนต์ของสารต่อไปนี้
ก. Cl2O ข. COCl2
ค. ClO3 -ง. PO43-
วิธีทำในแต่ละข้อ ทราบสูตรเคมี นอกจากนั้นยังต้องทราบเวเลนต์อิเล็กตรอนของแต่ละธาตุ
คือ C , P , O และ Cl มีเวเลนต์อิเล็กตรอนเป็น 4 , 5 , 6 และ 7 ตามลำดับ
3. 3. 5 สภาพกของโมเลกุลโคเวเลนต์
สารโคเวเลนต์ที่เกิดจากอะตอมชนิดเดียวเช่นแก๊สไฮโดรเจน
(13) มีการกระจายของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมทั้งสองเทากันพันธะที่เกิดขึ้นในลักษณะเช่นนี้เรียกว่าพันธะโคเวเลนต์ไม่มีขั้ว
(non-polar covalent bond) แต่สารโคเวเลนต์ที่เกิดจากอะตอมต่างชนิดกันและมีค่าอิเล็กโทรเนกาติวิตีแตกต่างกันจะมีการกระจายของกลุ่มหมอกอิเล็กตรอนดูรวมพันธะระหว่างอะตอมไม่เท่ากันเช่นไฮโดรเจนคลอไรต์
(HCI) มีอิเล็กตรอนคู่รวมพันธะอยู่บริเวณอะตอมคลอรีนมากกว่าอะตอมไฮโดรเจนเพราะอะตอมคลอรีนมีค่าอิเล็กโทรเนกาติวิดีมากกว่าอะตอมไฮโดรเจนทำให้อะตอมคลอรีนแสดงบระจุไฟฟ้าค่อนข้างลบส่วนอะตอมไฮโดรเจนมีค่าอิเล็กโทรเนกาติดีน้อยกวาแสดงประจุไฟฟ้าค่อนข้างบวกพันธะที่เกิดขึ้นลักษณะเช่นนี้เรียกว่าพันธะโคเวเลนต์มีขั้ว
polar covalent bond) การแสดงตัวของพันธะอาจใช้สัญลักษณ์ 6” (เดลต้าบวกสำหรับอะตอมที่แสดงประจุไฟฟ้าค่อนข้างบวก
(partual positive charge) และ 6 เดสต้าลบสำหรับอะตอมที่แสดงประจุไฟฟ้าค่อนข้างลบ
(partial negative charge) หรืออาจใช้เครื่องหมายโดยให้หัวลูกศรชีไปในทิศของอะตอมที่แสดงประจุไฟฟ้าค่อนข้างลบส่วนท้ายลูกศรที่มีลักษณะคล้ายเครื่องหมายบวกให้อยู่บริเวณอะตอมที่แสดงประจุไฟฟ้าค่อนข้างบวก
ขั้วของพันธะทำให้โมเลกุลอะตอมคู่ที่ประกอบด้วยธาตุขนิดเดียวกันเช่น H3
0, Cl๖ เป็นโมเลกุลไม่มีขัว (non ส่วนโมเลกุลอะตอมคู่ที่ประกอบด้วยธาตุตางยนัดกันเป็น
FIGI CO เป็นโมเลกุลมีขั้ว (polar molecule แล้วโมเลกุลโคเวเลนต์ที่ประกอบด้วยอะตอมมากกว่า
2 อะตอมและพันธะระหว่างคู่อะตอมเป็นพันธะมีขั้วจะเป็นโมเลกุลมีขั้วหรือไม่อย่างไรสภาพขั้วของโมเลกุลที่ประกอบด้วยอะตอมมากกว่า
2 อะตอมพิจารณาจากการรวมสภาพตัวของพันธะแบบเวกเตอร์ซึ่งถ้าเวกเตอร์หักล้างกันหมดจะทำให้โมเลกุลไม่มีขัวแต่ถ้าเวกเตอร์หักล้างกันไม่หมดโมเลกุลจะเป็นโมเลกุลมีชั่วเช่นโมเลกุลแก๊สคาร์บอนไดออกไซด์
(CO.) มีรูปร่างโมเลกุลแบบเส้นตรงและมีเวกเตอร์สภาพขั้วของพันธะ (= 0
สองพันธะในทิศทางตรงข้ามกันจึงหักล้างกันหมดทำให้
GO, เป็นโมเลกุลไม่มีขั้วดังนี้โมเลกุลที่อะตอมกลางไม่มีสีเล็กตรอนคู่โดดเดี่ยวและอะตอมล้อมรอบเหมือนกันทุกอะตอมเป็นโมเลกุลไม่มีขั้วถึงแม้ว่าพันอะภายในโมเลกุลจะเป็นพันธะที่มีขั้วเนื่องจากรูปร่างโมเลกุล
ตัวอย่างโมเลกุลโคเวเลนต์ไม่มีขั้ว

สำหรับโมเลกุลที่อะตอมกลางมีอิเล็กตรอนดู่โดดเดี่ยวหรือมีอะตอมล้อมรอบเป็นธาตุต่างชนิดกันส่วนใหญ่เป็นโมเลกุลมีขั้วเนื่องจากเวกเตอร์สภาพขั้วของพันธะหักล้างกันไม่หมดเช่น
H2O NH3 CHCl3
ตัวอย่างโมเลกุลโคเวเลนต์มีขั้ว


ไม่มีความคิดเห็น:
แสดงความคิดเห็น